viernes, 30 de octubre de 2015
martes, 13 de octubre de 2015
LOS NÚMEROS
CUÁNTICOS
Para explicar el modelo mecano-cuántico del átomo, Erwin Schrödinger utilizó una ecuación llamada ecuación de onda. ¨
Entre las soluciones de dicha ecuación aparecían unos números llamados números cuánticos.
Los números cuánticos son cuatro números que definen la energía y la localización de los electrones en los átomos. Están relacionados con los orbitales atómicos (regiones del espacio donde la probabilidad de encontrar al electrón es máxima).
¿Cuál
es el significado y los valores posibles de los números cuánticos?
- Nº cuántico principal (n): puede tomar valores enteros
(1, 2, 3...) y coincide con el mismo nº cuántico introducido por Bohr.
Está relacionado con la distancia promedio del electrón al núcleo en un
determinado orbital y, por tanto, con el tamaño de éste e indica el nivel
de energía.
- Nº cuántico secundario (ℓ): puede tener todos los valores
desde 0 hasta n – 1. Está relacionado con la forma del orbital e indica el
subnivel de energía.
- Nº cuántico magnético (m): puede tener todos los valores
desde - ℓ hasta + ℓ pasando por cero. Describe la orientación espacial del
orbital e indica el número de orbitales presentes en un subnivel
determinado.
nºcuántico
|
posibles valores
|
|
n
|
principal.
|
1,2,3...
|
l
|
secundario
|
0,..(n-1),
|
m
|
magnético
|
-l, ...,0,...,+l
|
Cada trío de valores de
estos números describe un orbital.
(n, ℓ, m) DEFINEN UN ORBITAL
ejemplos:
(3,0,0) =
orbital 3s
(3,1,.-1) =
orbital 3px
(3,1,0) =
orbital 3py
(3,1,1) =
orbital 3pz
Además se consideró que los electrones podían girar
en torno a un eje propio, bien en el sentido de las agujas del reloj, bien en
el sentido contrario. Para caracterizar esta doble posibilidad se introdujo el nº
cuántico de espín (s) que toma los valores de + ½ o - ½
Cada cuaterna de valores de estos números define a un
electrón en un orbital determinado
(n, ℓ, m, s) DEFINEN A UN ELECTRÓN EN UN ORBITAL DETERMINADO
Recordar que en cada nivel de energía, el número máximo
de electrones viene dado por 2n2
APPLET NÚMEROS CUÁNTICOS
Funcionamiento
del applet
Modifica
los tres números cuánticos y observa su representación.
En
la columna de la izquierda puedes modificar los valores de los números
cuánticos del átomo de Hidrógeno. Al hacer clic sobre "Dibuja" se
representaran:
1. La línea del plano XZ que
encierra la región del espacio en la que hay una probabilidad máxima de
encontrar al electrón con tales números cuánticos.
2. La región del espacio en
la que es más probable que se encuentre el electrón (orbital)
Este
programa sólo representa los orbitales del átomo de Hidrógeno entre n=1 y n=50.
ACTIVIDADES
1.
Indica cuántos orbitales pueden existir
a) en
el primer nivel de energía;
b) en el segundo nivel de energía.
Escribe como se denominan, dibújalos e
indica los tres números cuánticos que caracterizan cada uno de ellos. Comprueba
tus respuestas por medio del applet y realiza un informe con los resultados
obtenidos.
2.
Describe la forma geométrica y el número de orbitales
s, p y d que hay en el tercer nivel de energía. Describe los tres números
cuánticos que caracterizan a cada uno de ellos. Compruébalo mediante el applet.
3. Indica razonadamente si las siguientes ternas de
números cuánticos (n,l,m) pueden representar un orbital. Indica en cada caso a
cuál y compruébalo mediante el applet
a) (1,0,0); b) (0,0,0) c) (1,1,1) d) (2,0,0)
e) (2,0,1), f) (2,1,0) g) (2,1,1); h) (2,1,-1);
e) (2,0,1), f) (2,1,0) g) (2,1,1); h) (2,1,-1);
i) (2,2,0); j) (3,1-1); k) (3,2,1); l) (1,2,3)
4. ¿Cuáles de las siguientes designaciones de orbitales
no son posibles:7s, 2d, 6p, 0s, 4f, 1p, 2p, 3p y 3f?
5.
Indica cuál o cuáles de los siguientes grupos de tres
valores correspondientes a los números cuánticos n, ℓ y m están permitidos: a)
(3, -1, 1); b) (3, 1, 1); c) (1, 1, 3); d) (5, 3, -3); e) (1, 0, 1); f) (4, 2,
0); g) (7, 7, 2).
6.
Un electrón de un átomo está en el nivel cuántico n =
3. Enumera los posibles valores de ℓ y m.
LA CONFIGURACIÓN ELECTRÓNICA
El conocimiento de la distribución de los
electrones en los distintos orbitales es muy importante para entender las
propiedades de los átomos. Esta información se expresa mediante la configuración electrónica.
Se llama
configuración electrónica de un átomo al modo en que están distribuidos los
electrones alrededor del núcleo de ese átomo.
Para
realizar la configuración electrónica de un átomo, los orbitales se representan
de la siguiente forma:
ESTADO BASAL Y ESTADO EXCITADO DE UN ÁTOMO
En un átomo en estado normal (también llamado estado fundamental o estado basal), los electrones se
ubican lo más cerca que pueden del núcleo, siempre de forma ordenada. (Es el
estado en el que los electrones de un átomo consumen la menor cantidad de
energía posible) .Cuando un átomo está excitado quiere decir que
ha absorbido energía y sus electrones se han movido a un nivel de mayor energía
(se han alejado del núcleo).
PRINCIPIOS FUNDAMENTALES DE DISTRIBUCIÓN
PROBABLE DE ELECTRONES.
Es
posible expresar la configuración electrónica probable de cualquier átomo de un
elemento en su estado basal ,considerando
el número máximo de electrones por orbitales,
subniveles y niveles de energía
así como
los siguientes principios:
- PRINCIPIO DE EXCUSIÓN DE PAULI
- REGLA DE HUND O PRINCIPIO DE LA
- MÁXIMA MULTIPLICIDAD ELECTRÓNICA
- PRINCIPIO DE EDIFICACIÓN PROGRESIVA O REGLA DE AUF – BAU
PRINCIPIO
DE EXCUSIÓN DE PAULI
Establece
que no es posible que dos electrones en el mismo átomo tengan sus cuatro
números cuánticos iguales es decir que en un orbital solo puede
haber como máximo 2 electrones
siempre que tengan spin opuesto.
REGLA DE
HUND O PRINCIPIO DE LA MÁXIMA MULTIPLICIDAD ELECTRÓNICA
Cuando una serie de orbitales de igual energía (p, d , f) se están
llenando con electrones, éstos permanecerán desapareados mientras sea posible,
manteniendo los espines paralelos
PRINCIPIO
DE EDIFICACIÓN PROGRESIVA O REGLA DE AUF – BAU.
Este principio establece
que al realizar la configuración electrónica de un átomo cada
electrón ocupará el orbital disponible de mínima energía.
Este principio
también se conoce como regla de las diagonales, considerando las energías
relativas de los orbitales de un átomo poli electrónico el orden de llenado de
orbitales se podrá determinar por la siguiente figura siguiendo las líneas
diagonales:
De acuerdo
con la figura anterior el orden de ocupación progresiva será:
1s, 2s, 2p, 3s, 3p, 4s, 3d,
4p, 5s, 4d, 5p, 6s, 4f, 5d,
6p, 7s, 5f, 6d, 7p
ejemplo: calcula los cuatro números cuánticos del
orbital: 4d6
Ahora haz tú los siguientes ejercicios:
- 2Calcular los 4 números cuánticos de 3p5
- 3Calcular los 4 números cuánticos de 4d3
- 4Calcular los 4 números cuánticos de 6f7
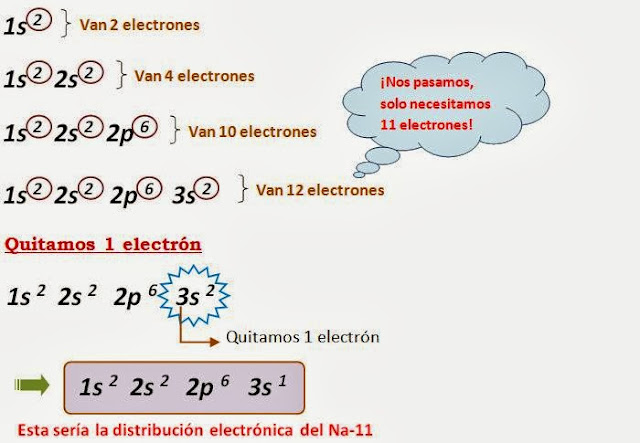
Procederemos a distribuir los 11 electrones según la tabla
Ahora haz tú la configuración electrónica de los siguientes elementos
1) 6C
2) 35Br
3) 20Ca
4) 79Au
SIMULADOR ORDEN DE LLENADO DE LOS ORBITALES
NOTAS:
1. Configuración
Electrónica abreviada
El
método del Kernel,
es una abreviación de la configuración de un gas noble. Los gases nobles son:
helio (2He),
neón (10Ne),
argón (18Ar),
kriptón (36Kr),
xenón (54
Xe) y radón (86Rn).
Para enterderlo, nos ayudaremos de la tabla periódica de la página 207 del libro de texto
Así por ejemplo, la configuración electrónica abreviada del 13Al sería:
13Al
: [10Ne] 3s2 3p1
2. Electrones de valencia
Se llaman electrones de valencia a los electrones responsables del comportamiento químico de los átomos. Son los electrones situados en el último nivel. Por ejemplo, en el ejemplo anterior, vemos que el nivel de valencia del átomo de alumnio es el 3. En él hay 3 electrones de valencia (3s2 3p1).
Averigua el nivel de valencia de
De los electrones de valencia dependen las propiedades de los elementos y los compuestos químicos que forman, puesto que son los electrones que intervienen en los procesos químicos.
Los gases nobles tienen su último nivel completo: no caben en él más electrones. Por ello decimos que tienen 8 electrones de valencia, a excepción del helio, que tiene 2.
3. Valencia de un elemento
La valencia de un elemento es la capacidad que tiene para combinarse con otro.
Los gases nobles tienen valencia cero, pues tienen completo su último nivel de electrones, lo que les da gran estabilidad y por eso sus átomos no se combinan. Los demás elementos tienden a alcanzar la configuración de un gas noble, por eso sus átomos se combinan con una valencia que depende del número de electrones que tienen en su último nivel
SIMULADOR ORDEN DE LLENADO DE LOS ORBITALES
SIMULADOR ORDEN DE LLENADO DE LOS ORBITALES
domingo, 4 de octubre de 2015
EL MODELO ATÓMICO ACTUAL
MODELO ATÓMICO DE ERWIN SCHRÖDINGER
El físico E. Schrödinger
estableció el modelo mecano-cuántico del átomo, ya que el modelo de Böhr
suponía que los electrones se encontraban en órbitas concretas a distancias
definidas del núcleo; mientras que, el nuevo modelo establece que los
electrones se encuentran alrededor del núcleo ocupando posiciones más o menos
probables, pero su posición no se puede predecir con exactitud.
El modelo atómico
actual fue desarrollado durante la década de 1920. Es un modelo de gran complejidad matemática.
De cualquier modo, el
modelo atómico mecano-cuántico encaja muy bien con las observaciones
experimentales.
En este modelo:
- No se habla de órbitas, sino de orbitales: un orbital es una región del espacio en la que la probabilidad de encontrar al electrón es máxima.
- Los orbitales atómicos tienen distintas formas geométricas.
Vamos a profundizar un poco más en el concepto de orbital:
Podemos decir que un orbital es una función matemática que describe la región en torno al
núcleo donde existe mayor probabilidad de encontrar al electrón. Esto supone considerar al electrón como una nube difusa de carga alrededor del núcleo con mayor densidad en las zonas donde la probabilidad de que se encuentre dicho electrón es mayor.
Los estudios de Erwinn Schrödinger demostraron que existen distintos tipos de orbitales que se identifican con letras: s, p, d y f. La forma y el tamaño de un orbital dependen del nivel y del subnivel de energía en que se encuentra:
- Los orbitales s tienen forma esférica.
- Los orbitales p tienen forma de cacahuete (ocho).
- Los orbitales d y f tienen formas más complejas.
Además, el orbital s del nivel 2 (denominado 2s) es de mayor tamaño que el orbital s del nivel 1 (el 1s). Y lo mismo sucede si comparamos el 3s con el 2s (el 3s es mayor), o el 3p con el 2p.
El tipo de orbitales que hay en cada nivel también está determinado:
- En el primer nivel solo hay un orbital de tipo s
- En el segundo nivel hay orbitales de tipo s y p
- En el tercer nivel hay orbitales s, p y d
- En el cuarto nivel hay orbitales de tipo s, p, d y f
Cuando se llenan orbitales de la misma energía (3 orbitales p , 5 orbitales d o 7 orbitales f) primero se coloca un electrón en cada uno de los orbitales y, cuando todos tienen uno, se coloca el segundo(REGLA DE HUND). Esto ocurre porque esta configuración es la más estable.
En la simulación que tienes a continuación puedes elegir entre distintos tipos de orbitales y observar su forma geométrica.
SIMULADOR DE ORBITALES
1ª PARTE: ACTIVIDADES
1. La profesora dará las explicaciones de cada uno de los diferentes tipos de orbitales representando simultáneamente en la pizarra digital la forma y orientación de cada uno de los orbitales atómicos.
2. El alumno con las barras de plastilina hará lo siguiente:
a) Moldear dos esferas de diferente color para representar el orbital 1s y 2s.
b) Moldear 6 esferas con un extremo punteado y colocarlas sobre los palillos que están sujetos en una esfera y orientados sobre los ejes x, y, y z para representar los orbitales px, py, y pz.
c) Moldear 18 esferas con un extremo punteado, luego en una esfera colocará los ejes x, y, z, utilizando palillos. Después colocará las esferas en los puntos de intersección representando las orbitales dx-y, dx-z, y dyz, en otra esfera colocará con pica dientes los ejes x, y, z y representará los orbitales dx2-y2 y dz2.
En la simulación que tienes a continuación puedes elegir entre distintos tipos de orbitales y observar su forma geométrica.
SIMULADOR DE ORBITALES
LA TAREA
1ª PARTE: ACTIVIDADES
Después de haber leído el contenido de este texto, y de
haber utilizado el simulador de orbitales, los alumnos se reúnen en grupos de tres/dos y responden a las cinco cuestiones siguientes:
Se empleará la técnica de los LÁPICES AL CENTRO
Con esta dinámica se pretende que los alumnos aprendan la
importancia de escuchar a sus otros compañeros, de poner todas las ideas en
común y entre todos planificar un resultado común.
Se entrega a cada grupo un problema en hojas individuales.
Los alumnos ponen los lápices en el centro para escuchar la tarea, pensar la
respuesta y consensuar la solución entre todos. Por ejemplo, cada uno de ellos
puede leer una pregunta en alto y se encargará de que todos los miembros del
equipo participen decir cuál es el método resolución (que no la solución). Se
trata de llegar a un consenso, pues cada grupo debe dar un único método de
resolución. Hasta que todo el mundo no lo tenga claro, no se puede coger el
lápiz para contestar en la hoja individual.
Si acertamos, acierta todo el grupo, pero si fallamos,
también el error es común a todo el grupo.
El mayor error en esta dinámica no es no dar con la
solución, sino que esta se deba a una falta de entendimiento entre los miembros
del grupo
2ª PARTE: PRÁCTICA DE LABORATORIO
Se desarrollará la práctica en equipo, con compromiso, respeto y orden durante la sesión.
OBJETIVO.
El propósito de esta práctica es que el alumno represente estructuralmente la forma y orientación de los orbitales atómicos.
MATERIAL REQUERIDO EQUIPO
1 caja de barritas de plastilina de colores
25 palillos de dientes
corcho para las bases
cartón
papel y rotuladores (para etiquetar cada maqueta)
tijeras y pegamento
cartón
papel y rotuladores (para etiquetar cada maqueta)
tijeras y pegamento
PROCEDIMIENTO:
2. El alumno con las barras de plastilina hará lo siguiente:
a) Moldear dos esferas de diferente color para representar el orbital 1s y 2s.
b) Moldear 6 esferas con un extremo punteado y colocarlas sobre los palillos que están sujetos en una esfera y orientados sobre los ejes x, y, y z para representar los orbitales px, py, y pz.
c) Moldear 18 esferas con un extremo punteado, luego en una esfera colocará los ejes x, y, z, utilizando palillos. Después colocará las esferas en los puntos de intersección representando las orbitales dx-y, dx-z, y dyz, en otra esfera colocará con pica dientes los ejes x, y, z y representará los orbitales dx2-y2 y dz2.
para facilitar el trabajo de maquetación de los orbitales d, fijate atentamente en las indicaciones que vienen a continuación:
AUTOEVALUACIÓN
Los alumnos utilizarán la siguiente diana de evaluación para evaluar su trabajo en el laboratorio:
La escala a utilizar en la autoevaluación mediante la diana será la siguiente:
0
|
NADA/MUY
MALO
|
1
|
POCO/MALO
|
2
|
NORMAL/BUENO
|
3
|
MUCHO/MUY
BUENO
|
Se pondrá un punto en la diana a lo largo de cada flecha (ítem a evaluar)
siguiendo la escala de la tabla anterior. Uniendo los puntos obtenidos
obtendrás un polígono. A mayor área del polígono mejor puntuación obtenida.
HETEROEVALUACIÓN
Para evaluar el trabajo de laboratorio, la profesora utilizará la siguiente rúbrica:
CALIFICACION
|
ACTITUDES
|
DESEMPEÑO EN
LAS ACTIVIDADES EN EL LABORATORIO
|
TAREAS
ESCRITAS
|
10
|
-Puntualidad y asistencia
-respeta
las reglas del laboratorio
-
trabajo en equipo
- muestra interés, respeta las ideas del los
compañeros
|
- participación activa en el trabajo de equipo
-
realiza todas las actividades.
-
uso adecuado de material e instalaciones
- proporciona ideas y/o soluciones frecuentemente
|
-
reviso bibliografía
-
realizo la tarea
-
contesto cuestionarios
-
resolvió los ejercicios
- entrego reportes a tiempo
|
9-8
|
-Algunas
veces hubo retardos
- en alguna ocasión no respeto las reglas del laboratorio
-
alguna vez no mostró interés y no respeto las ideas de los compañeros
- alguna vez no colaboro con el equipo
|
-
participación activa en la mayoría de las actividades
- proporciona ideas y/o soluciones algunas veces
-
|
La
mayoría de veces realizo las
actividades:
-
revisión de bibliografía
-
realizo la tarea
-
contesto cuestionarios
- resolvió los ejercicios
|
7-6
|
-
Presento varios retardos y alguna falta
-
varias veces no mostró interés.
- varias ocasiones no respeto las reglas de
laboratorio
|
- participa en algunas actividades en el trabajo de
equipo
-
usa algunos materiales de laboratorio
- proporciona algunas ideas y/o soluciones
|
Algunas veces
reviso
bibliografía
-
realizo la tarea
-
contesto cuestionarios
- resolvió los ejercicios
|
5- 0
|
-
Frecuentemente tuvo inasistencias
-
frecuentemente no mostró interés
- frecuentemente no respeto las reglas de
laboratorio
|
-
no participa en el trabajo en equipo
- tuvo muchas falta en laboratorio
|
No realizo:
reviso
bibliografía
- la tarea
- cuestionarios
-
la resolución los ejercicios
- reporte de practica
|
AUTOEVALUACIÓN FINAL: MI DIARIO DE APRENDIZAJE
Finalmente, para autoevaluar la tarea total realizada (actividades + práctica) cada alumno cumplimentará su diario de aprendizaje; donde responderá a las siguientes cuestiones:
1.
FECHA
2.
CONTENIDO
BÁSICO DE LA SESIÓN.
3. ¿CUÁLES
SON LAS PRINCIPALES IDEAS QUE DEBO RECORDAR DE LO TRATADO?
4.
HOY
HE APRENDIDO QUE….
5.
NO
ME HA QUEDADO CLARO…
6.
LO
QUE MÁS ME HA GUSTADO HA SIDO…
7.
LO
QUE MENOS ME HA GUSTADO HA SIDO…
8.
OTRAS
OBSERVACIONES (Comentarios)
Suscribirse a:
Comentarios (Atom)




.jpg)


.jpg)

.jpg)
.jpg)


.png)
.jpg)
.jpg)
.jpg)
.jpg)


.jpg)
.jpg)
.jpg)














.jpg)



































.jpg)

.jpg)
.jpg)



.jpg)
.jpg)
.jpg)
.jpg)







